神戸大学大学院理学研究科の林文夫名誉教授らは、光受容タンパク質ロドプシンが網膜の円板膜内で一過性のクラスターを形成することを近赤外波長での単一分子追跡で明らかにしました。また、この一過性のクラスターは円板膜中央部に偏って分布し、Gタンパク質シグナル伝達のための確率的プラットフォームを提供することを見出しました。
本研究成果は光信号受容の分子機構解明だけでなく、視細胞の形成?維持?病変の理解にも寄与すると期待されます。
本成果は、英科学誌Nature姉妹誌「Communications Biology」に6月14日付けで掲載されました。
本研究には神戸大学バイオシグナル総合研究センターの森垣憲一准教授、理学研究科の前川昌平名誉教授、浜松医科大学医学部の妹尾圭司准教授、自治医科大学医学部の齋藤夏美研究員らが参加しています。
ポイント
- 網膜視細胞の光受容膜 (円板膜) での光受容体タンパク質ロドプシンやGタンパク質トランスデューシンの一分子観察に世界で初めて成功しました。
- ロドプシンの一分子軌跡データから、ロドプシンは三つの拡散状態の動的平衡にあり自発的に1ミクロンに満たない瞬間的な集団を作ることが分かりました。
- 独自の観測手法によってロドプシンのクラスター形成を実証するとともに、円板膜内にはラフト※1 (脂質液体秩序相) への親和性の違いによる同心円状の構成的不均一が存在することが明らかになりました。
研究の背景
網膜視細胞は円筒形の光受容部を持っていますが、その中には直径数ミクロンの円板状の膜(円板膜)が1,000層ほど積層されています。円板膜は煎餅のような形をした脂質二層膜で、その中に光受容タンパク質ロドプシンが高濃度に組み込まれています。ロドプシンは細胞が外界の様子を知るために用意している多様なGタンパク質仲介型受容体 (GPCR) ※2 と呼ばれる膜タンパク質の代表格で、最も良く研究されたGPCRとも言われます。
しかし、近年になってもロドプシンが円板膜内で自由に拡散しているのか、はたまた結晶化しているのかさえ分かっていないのが実情でした。40年以上にわたる多数の分子の平均値を計測する類いの研究はロドプシンの拡散性を支持していますが、近年の原子間力顕微鏡などの構造生物学的研究はロドプシンの整然とした配列の存在を示唆しています。このようなロドプシンの存在の仕方についての考え方の対立は、視細胞が光を感知する分子機構やその調節機構についての議論の基盤が確立していないことを意味していました。
さらに、ロドプシンが単独で拡散しているのか、あるいは何らかの集団を作っているのかという問題は、単に膜内でのタンパク質の存在の仕方にとどまらず、膜の脂質の存在の仕方にも重要な意味を持ちます。生体膜を構成する脂質には、コンパクトな飽和脂肪酸をもつ脂質と、かさばった不飽和脂肪酸鎖をもつ脂質があり、前者はコレステロールと共に集まって液体秩序相 (ラフト) を作りやすく、後者は比較的流動的な液体非秩序相 (非ラフト) を作る傾向があります。このような膜のラフトと非ラフトへの相分離はタンパク質の膜内局在や活性調節に関与すると考えられ、1990年代末から生体膜研究の重要課題として注目されてきました。既に林名誉教授らは2個のロドプシンが近接すると劇的にラフトに親和的になることを発見しており、円板膜内でロドプシンが集団を作ればそれは一種のラフトになることを推定していました。
そこで本研究では、最新の技術と解析手段を使って、ロドプシンや脂質が円板膜内でどのような状態で存在するのか、またそれらはラフトとどういう関係にあるのかなどを探究しました。
研究の内容
視細胞円板膜内のロドプシンの一分子観察
細胞内で生体分子がどのように存在するのかを明らかにするには、その分子を蛍光標識して一分子観察するのが有効です。もし結晶化しているならロドプシンは止まっているでしょうし、自由に拡散しているなら膜内でのブラウン運動が見られるはずです。しかし、ロドプシンは光を感じるタンパク質ですから、一般に使われている可視光領域では、ロドプシンを刺激してしまうため、蛍光一分子観察はできません。そこで我々はロドプシンを刺激しない近赤外領域での蛍光一分子観察に挑戦しました。予備実験の結果、ロドプシンが円板膜内をかなり自由に拡散していることは確認できましたが、それ以上のことは分かりませんでした。そこで、もしロドプシンが一過的な結晶あるいはクラスターを作っているなら一分子の軌跡の中にゆっくりした部分や速く拡散している部分があるはずだと考え、その有効性が近年知られるようになったベイズ推論による機械学習※3 を利用して一分子軌跡の中の異なる拡散状態の抽出を試みました。個々のロドプシン分子が拡散によって描く「軌跡」(図1左) を500個ほど集め、変分ベイズ隠れマルコフモデル解析 (vbSPT in GitHub) にかけると、3状態モデルが得られ (図1中)、ロドプシンは3種の拡散状態間を遷移しながら拡散していることが分かりました (図1右)。2量体の大きさを4nmとすると最も遅い拡散状態は100nm以上の大きさのクラスターであると推定されました。
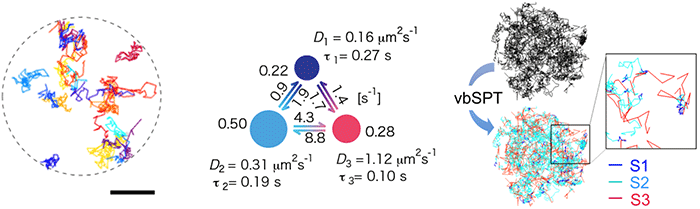
(左) 円板膜内で拡散するロドプシンの軌跡 (分子毎に色分け)。
(中) ベイズ推論による機械学習で得られた3状態動的平衡モデル。
(右) 円板膜中のロドプシンの軌跡の中に見られる3状態 (赤:速い、薄青:中間、紺:遅い)。
クラスターの生成消滅
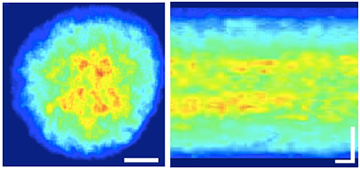
(左) 円板膜中央部に見られるロドプシンのクラスター (静止画像)。スケールバー:2ミクロン。
(右) ロドプシン密度の時間経過。スケールバー:横 0.1秒、縦 2ミクロン。
ロドプシンの蛍光標識率を増やすと、生成消滅を繰りかえすロドプシンの集団 (クラスター) を観察できることが分かりました (図2)。クラスターの拡散速度や寿命などの性質は一分子観察に基づくベイズ推論で得られた最も遅い拡散状態と良く一致しました。同時にロドプシンの円板内分布はこれまで考えられてきたような均一なものではなく、辺縁部には疎に、中央部には密にロドプシンが分布し、中央部でクラスターを作りやすくなっていることが分かりました。
円板膜の中央部と辺縁部で脂質やタンパク質の密度が不均一
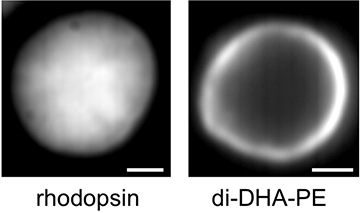
(左) 円板膜内でのロドプシンの中央に偏った分布 (平均画像)。
(右) 円板膜内の非ラフト的脂質 (di-DHA-PE) の辺縁部に偏った分布 (平均画像)。
ロドプシンはお互いに近接するとラフト親和性になることから、ロドプシンのクラスターはラフトに親和的であると考えられました。円板膜中のロドプシンの分布は中央に偏っていますので (図3左)、円板の中央部にはラフト親和性のタンパク質や脂質分子が集まりやすく、辺縁部には非ラフト親和性の膜分子が集まりやすいことが示唆されました。この仮説は、典型的な非ラフト的リン脂質である2本の高度不飽和脂肪酸鎖 (DHA) を持つホスファチジルエタノールアミン (di-DHA-PE) が辺縁部に局在することを示す事によって実証することができました (図3右)。
まとめ
本研究によって、(1) ロドプシンはラフト親和性クラスターを作り、Gタンパク質トランスデューシンの活性化に寄与する瞬間的な足場を提供している、(2) ロドプシンのクラスターや二量体は円板膜辺縁部の非ラフト的膜から排斥され、中央部に集められていることなどが分かりました。これらの発見は細胞を構成する様々な他の膜でも同様の瞬間的な不均一や周囲の枠組に規定された構成的不均一さが予想外の重要な役割を持つことを示唆しています。
今後の展開
私達の眼の視細胞は、非常に弱い光から生活光強度まで広く対応できる調節機能を持ちますが、なぜそんな高度な機能が実現できるのかについては良く分かっていないのが現状です。本研究成果は、これらの問題の解明に不可欠な、極めて基礎的な知見を提供するものです。視細胞の複雑な形態形成や維持、そして網膜色素変性症など病変の理解にも基礎研究の進展は欠かせません。ここでは、光情報変換系の活性化過程に関与する分子に焦点を当てましたが、不活性過程も未解明な領域です。人工膜を使った構成的な研究手法も使いながら、活性化?不活性化両過程の研究を進展させたいと考えています。
用語解説
- ※1 ラフト
- 生体膜の脂質液体秩序相に親和性を持つ脂質やタンパク質の小さくて短寿命の集団。細胞膜での情報変換にとどまらず、様々な免疫機構や、細菌やウイルスの感染、アルツハイマー病罹患などとも深い関連が指摘されている。
- ※2 Gタンパク質仲介型受容体
- 細胞が外界からの刺激を受容するときに使われる細胞表面に露出した膜タンパク質で、GTP結合タンパク質(Gタンパク質)を信号の仲介役として使う。ホルモン、神経化学伝達物質、味物質や匂い物質、フェロモン、光などの多くの受容体が含まれる。
- ※3 ベイズ推論による機械学習
- 多量のデータから未観測値に対する条件付き分布の推論を行うコンピューター技術。
論文情報
- タイトル
- “Raftophilic rhodopsin-clusters offer stochastic platforms for G protein signalling in retinal discs”
(ラフト親和性のロドプシン?クラスターは網膜円板膜のGタンパク質信号系に確率的な信号足場を提供する) - DOI
- 10.1038/s42003-019-0459-6
- 著者
- 林 文夫1,齋藤夏美1?、谷本泰士2、岡田佳祐2、森垣憲一2,3、妹尾圭司4、前川昌平1
1 神戸大学大学院理学研究科
2 神戸大学大学院農学研究科
3 神戸大学バイオシグナル総合研究センター
4 浜松医科大学医学部
? 現職:自治医科大学医学部研究員 - 掲載誌
- Communications Biology